过去40年的想法回荡了。
2024年6月6日,Geron Corporation(NASDAQ:GERN,以下称为Geron)宣布,FDA批准了Imetelstat(商品名:Rytelo),用于治疗低风险的低风险骨髓增生剂综合征(LR-MDS)的成年患者。如果存在输血依赖性贫血,则需要在8周内进口4个或更多的红细胞单位,并且患者对红细胞生成刺激剂(ESA)没有反应,或者不适合ESA。
低风险的骨髓发育异常综合征(LR-MDS)是血液癌。随着疾病的进展,患者将需要逐渐加强诸如贫血和疲劳之类的对照,这使得LR-MDS患者经常依靠红细胞。输血导致生活质量降低和缩短生存。对于ESA治疗失败的患者,现有的治疗选择仅限于特定的亚群,因此在临床上提供了连续的,长期独立的红细胞输血疗法的未满足。
Rytelo是Geron花费了33年发展的“一流”端粒酶抑制剂。它也是美国FDA批准的第一个端粒酶抑制剂。自1984年发现端粒酶以来,经过将近40年的等待,该行业终于迎来了第一个以端粒酶为目标的治疗。 Rytelo被行业媒体评估列为2024年204年潜在的大片疗法之一。
01“生命时钟”端粒酶
严格来说,在端粒酶方面,有必要将时间转到1930年代,即最初发现端粒。当时,芭芭拉·麦克林托克(Barbara McClintock)和赫尔曼·穆勒(Herman Muller)是美国遗传学和两个诺贝尔奖获奖者的先驱,在实验中发现,玉米和果蝇果蝇的染色体末端非常稳定,在破裂后不会融合。像许多当时具有良好古典素养的科学家一样,穆勒(Muller)拿到了希腊电视(End)和梅罗斯(Meros)(部分),并命名了这种特殊的结构端粒。
1961年,一位年轻的学者意外地发现,在体外培养时,细胞只能分裂有限的次(50±10次),并提出了“细胞不能永远生存”的评论,这打破了的想法当时学术界通常认可的“细胞是不朽的”。因此,科学界对细胞微观领域的探索加速了其步伐。十年后,美国学者提出了DNA复制不对称的问题,预测每种细胞分裂将导致链末端的染色体片段丧失,从而引入“终端复制问题”。
1984年,在研究了单细胞生物后,分子生物学家发现了一种端粒酶,该端粒酶保持端粒长度并揭示其在人体中的特殊作用:除了人类生殖细胞和一些体细胞。 ,端粒酶几乎不适用于其他所有细胞,但它保持癌细胞端粒的长度,从而可以无限地扩增。
1990年,三位科学家,加尔文·哈雷(Calvin Harley),料理和格雷德(Greider)联手发现,当人类成纤维细胞在体外进行培养时,端粒将随细胞分裂而缩短,而短端粒的积累最终将触发“ heflik限制”。
简而言之,较小的单元格,端粒越短;细胞年龄较小,端粒和端粒与细胞衰老有关。衰老细胞中的一些端粒失去了大多数端粒重复序列。当细胞的端粒受损时,发生衰老,而当端粒缩短到临界长度时,衰老会加速和死亡。
其次,正常细胞的端粒较短。细胞分裂将缩短端粒,分裂一次,缩短一点,就像戴铁棒一样。如果仅剩下一个残留的根,则细胞将接近衰老。细胞分裂一次,失去约30-200 bp(基对)。
细胞中有一种可以合成端粒的酶。端粒复制不能用经典的DNA聚合酶催化,而是通过特殊的逆转录酶,端粒酶来完成的。在正常的人类细胞中未检测到端粒酶。在某些良性病变细胞(体外培养的成纤维细胞)中未检测到端粒酶活性。但是,该酶在生殖细胞,睾丸,卵巢,胎盘和胎儿细胞中为阳性。
从那时起,端粒已被添加到“细胞寿命”队列中,该队列可以衡量寿命的长度并谈论无法避免衰老的时间。
当阐明端粒酶的组成时,1997年,由著名的西班牙学者Maria A. Blasco领导的世界上第一个端粒酶编辑模型小鼠出生,随后在许多研究中广泛使用。
2009年10月5日,瑞典皇家科学院诺贝尔奖委员会宣布,它将授予2009年诺贝尔生理学或医学奖,授予伊丽莎白·布莱克本(Elizabeth H. Blackburn),卡罗尔·W·格里德(Carol W.端粒和端粒”。酶如何保护染色体”。
其中,布莱克本(Blackburn)和Szostak发现,特殊的端粒DNA序列可以防止染色体降解,而Greider和Blackburn发现了一个有助于端粒合成的分子 - 端粒酶。他们的发现阐明了端粒酶的作用 - 稳定端粒的长度和结构,从而保护染色体。同时,端粒和端粒酶不仅与染色体的特征和稳定性密切相关,而且还涉及细胞衰老和损伤以及癌症的发生。
02几个简单的指示
1990年,Geron由迈克尔·韦斯特(Michael West)在特拉华州建立,他是干细胞,细胞衰老和端粒酶研究的先驱,以及克莱纳·珀金斯·卡菲尔德(Kleiner Perkins Caufield)和拜尔斯(Byers)的合伙人亚历克斯·巴尔卡斯(Alex Barkas),也是著名的风险投资家。在1992年,1993年和1994年,分别在1995年完成了A,B,C和D的融资。
1996年,Geron成功在纳斯达克公开公开,2009年诺贝尔生理学或医学奖的三个获奖者以及著名的美国生物学家伦纳德·海弗利克(Leonard Hayflick)(他提出了“ Hayflick Limit”)成为该公司的科学科学。当时的顾问。
然后,就像一家典型的科学研究成就转型公司一样,Geron也开始了并购的道路。 1999年,Geron收购了Roslin Bio-Med和核移植技术。 2002年,该公司从Lynx Therapeutics收购了磷酸盐化学IP资产。
2003年,Geron开发了与端粒酶RNA模板结合的寡核苷酸,并竞争抑制端粒酶活性。 2004年,他获得了Argos Therapeutics(以前为Merix Bioscience)的独家授权,以开发端粒酶为抗原。树突状细胞治疗癌疫苗。 2005年,Geron通过使用脂质修饰增强了该端粒酶抑制剂的功效,而Imetelstat诞生了。因此,imetelstat基本上是脂质耦合的13-Mer寡核苷酸。
Imetelstat能够与人端粒酶(HTR)的RNA模板区域结合,从而抑制端粒酶活性并阻止端粒结合过程。研究表明,在骨髓增生综合征和某些恶性肿瘤的干细胞和祖细胞中,端粒酶的活性以及人端粒酶逆转录酶(HTERT)的RNA表达增加。非临床实验表明,iMetelstat治疗可以减少端粒长度,降低恶性茎和祖细胞的增殖速率,并诱导细胞凋亡。
从那时起,当Geron探索Imetelstat时,他还致力于进入干细胞领域。但是,在2011年,由于商业原因,该公司放弃了干细胞疗法,因此imetelstat再次引起了市场的关注。直到这次,imetelstat在第二阶段的乳腺癌临床治疗中失败了,导致公司的股价直接下跌了56%。
及时停止损失已成为关键。 Geron还停止了Imetelstat的非小细胞肺癌试验,该试验被用作单一药物。该公司特此研究患有较短端粒的肿瘤患者(染色体的保护端),发现在该亚组中服用imetelstat的患者(共有19例患者)比安慰剂的患者缓慢进展。这为Imetelstat随后的研究和开发定下了基调:作为单一代理的iMetelstat旨在抑制负责延长端粒的酶。从短端粒开始,让该药物抓住该倡议,将使药物更容易杀死肿瘤细胞。
Imetelstat的临床试验(例如非小细胞肺癌和神经胶质瘤)都失败了。 Geron仍然需要在指示选择方面改变他的策略:为了使产品生效,Geron决定首先将其研发重点转移到血肿。但更重要的是,找到一个强大的业务伙伴。
03命运很糟糕,底部是反弹
2014年11月13日,Geron与Janssen Biotech,Inc。签署了一项联合研究和授权协议,以开发和商业化全球肿瘤学的Imetelstat指示,包括:血液学恶性肿瘤和其他人类治疗用途。
2014年11月13日,Johnson&Johnson的子公司Geron和Janssen Pharmaceutical在Imetelstat上达成了全球战略合作,总交易量高达9.35亿美元,旨在共同促进发展和商业化。在合作期间,imetelstat进行了两个研究骨髓增生综合征(MDS)和骨髓纤维化(MF)的两个阶段。但是,詹森药物的添加仍然无法恢复临床数据。两项研究的结果不符合约翰逊和约翰逊的期望,双方在2018年终止了合作。
2023年1月,GERON报告了Imerge的Pivotal 3阶段临床试验的阳性顶线结果,该试验评估了Imetelstat在TD LR-MDS患者(输血依赖性低风险的脊髓塑性综合征)中的疗效,并注意到该试验达到了主要的端点和主要端口和主要端口和主要端点和主点和主要的次要终点,研究结果于2023年12月发表在“柳叶刀”中。
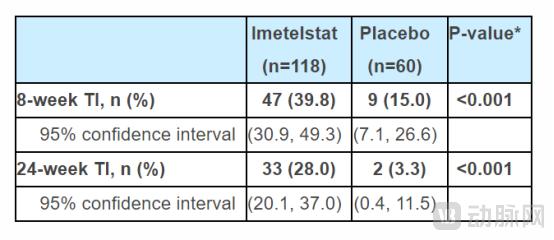
这项随机的双盲,安慰剂对照的临床试验评估了imetelstat在低和低风险MDS患者中的疗效和安全性,这些患者是复发/难治性患者,依赖于输血,并且耐受性或不可忍受。试验结果表明,在治疗8周时,39.8%的imetelstat在输血中仍然不可靠,安慰剂组的值为15.0%(Rytelo:39.8%,95%CI:30.9-49.3:30.9-49.3;安慰剂:15.0%:15.0%,95%,95%,95%,95%,95%,95%,95%,95%。 %CI:7.1–26.6; p
在对接受RYTELO治疗的RBC-TI的Rytelo患者进行的探索性分析中,Rytelo的中位血红蛋白增加为3.6 g/dL,安慰剂组的Rytelo治疗中位数为3.6 g/dL和0.8 g/dl。在关键的MDS亚组中观察到临床上显着的疗效结果,无论患者的环状铁幼虫宫颈(RS)状态,基线输血负担和国际预后评分系统(IPSS)风险类别。
在Imerge试验中,Rytelo表现出良好的安全性,并且血小板减少症和中性粒细胞减少症的患者通常会在短时间内进行控制和持续。
总体而言,Imetelstat显示出明显更高的红细胞输血独立性(RBC-TI)。在接受Rytelo治疗的患者中,RBC-TI长期维持,分别为8周的响应者和24周的响应者RBC-TI的中位持续时间。
但是,此答案并不满足端粒酶领域中的所有追随者。
首先要承担的是FDA简报文件,该文件质疑imetelstat在治疗骨髓增生综合征中的批准。
首先,就次要终点而言,IMERGE第3阶段临床试验并未表明iMetelstat对其他次要终点有益,包括完全缓解,部分缓解,整体生存以及红细胞血液血液学领域的改善。 FDA声称这些发现不支持Geron的说法,即端粒酶抑制剂Imetelstat可以改善病情。
其次,iMetelstat仍然具有功效缺陷。特别令人担忧的是,两个肝酶升高的病例与Hey定律的实验室定义一致,这表明该患者有致命的药物诱发肝损伤的风险。此外,响应时间和潜在的毒性也引起了对Imetelstat发射的隐藏问题。
在2024年3月14日,美国FDA急剧基于Imerge 3阶段临床试验的结果。最后,委员会对12:2投票赞成,imetelstat的临床益处胜过风险。新闻宣布的第二天,Geron的股价飙升了92%。同年6月6日,Rytelo(Imetelstat)成功地批准了,比以前设定的PDUFA日期提前10天。也就是说,FDA确定iMetelstat的总体好处大于风险。
根据使用指南,rytelo注射的是白色至灰白色或浅黄色冷冻干燥粉末,没有防腐剂,并提供了两种单剂量规格的小瓶装小瓶包装47毫克和188毫克。建议将rytelo剂量供每位患者以7.1 mg/kg的速度使用。 ,应在2小时内通过静脉输液完成,每4周完成一次。
根据Visible Alpha的数据,到2035年,Rytelo的销售额可能达到21亿美元。
04端粒酶药物的其他可能性
除了低风险的骨髓增生综合征(MDS)外,Geron还正在开发用于治疗其他髓样血液学恶性肿瘤(例如骨髓纤维纤维化(MF))的imetelstat。根据统计数据,美国大约有13,000名MF患者,每年报告约3,000例新病例,约有70%的患者被归类为中型2风险或高风险。对于无效治疗JAK抑制剂或耐药性的患者,未批准药物进行后续治疗,因此有很大的未满足医疗需求。
GERON的ImpactMF第三阶段临床试验正在评估iMetelstat中-2风险或高风险骨髓纤维化(MF)的患者,他们在接受JAK抑制剂后复发或对JAK抑制剂有抵抗力,称为MF患者,研究为总体,研究为总体上,研究为总体MF。生存(OS)作为主要终点。 2024年8月,该试验完成了约70%的患者入学人数。基于试验中目前计划的入学和事件(死亡率)的假设,Geron预计,ImpactMF研究OS的临时分析可以在2026年初进行,最终分析可能会在2027年初进行。
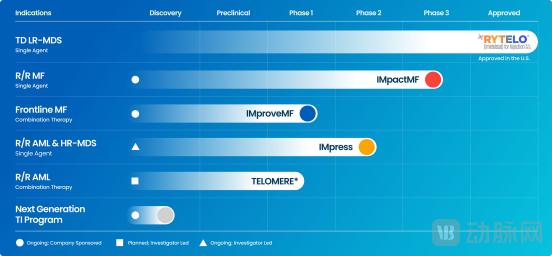
Geron管道研究
在全球范围内,除Rytelo外,还有许多研究不足的药物在临床前和临床阶段都靶向端粒酶,分别针对不同的适应症。
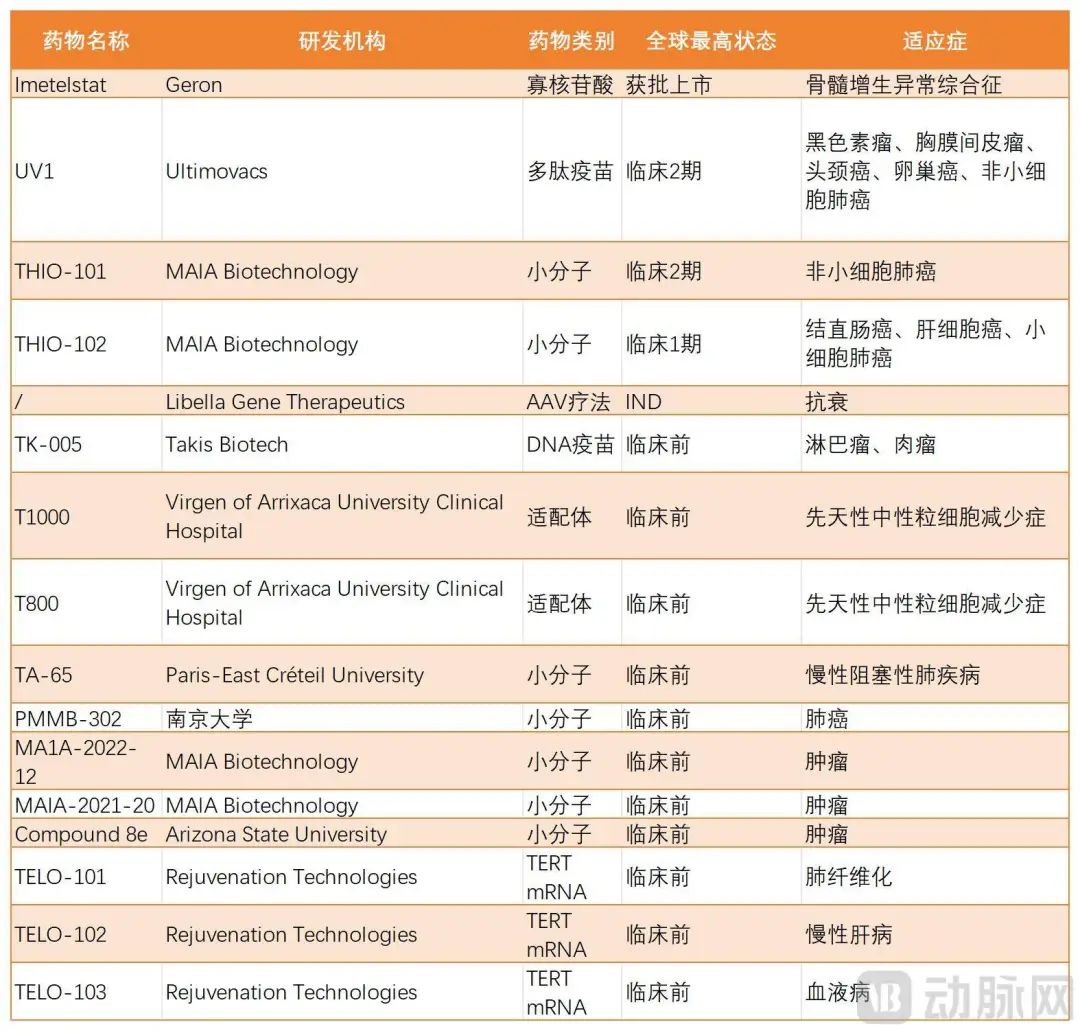
正在开发的全球端粒酶管道,动脉网络不完整的统计数据
其中,在其UV1 II期临床试验(NCT05075122)中,最快的Ultimovacs ASA(以下称为Ultimovacs)宣布了头颈鳞状细胞癌(HNSCC)的一流结果。但是,数据表明该研究未能达到其主要和次要终点。
这可能进一步强调了Rytelo上市的重要性。
“对于依赖输血依赖的贫血的较低风险MD的患者,几乎没有治疗选择和经常再循环现有治疗的患者,imetelstat的批准可能会改变我们的实践。”莫菲特癌症中心的共同投资者Rami Komrokji博士在Geron的共同投资者“ Imetelstat都带来好处血红蛋白水平和安全性是可以控制的,”该公司的批准公告说。这种疾病患者的治疗目标是无输血,这对于许多患者来说是不可能的,直到iMitelstat被批准。”
更重要的是,经过40年的等待,该行业终于迎来了第一个以端粒酶为目标的治疗,而开拓者可以为许多继任者开辟一条新的道路。
本文来自由36KR出版的Wechat官方帐户,作者:Ning Chen。
本文采摘于网络,不代表本站立场,转载联系作者并注明出处:http://mjgaz.cn/fenxiang/274037.html

