4 月 4 日消息来自 IT 之家。复旦大学附属肿瘤医院今日进行了宣布。虞先濬教授团队是该院院长,该团队联合了北京大学肿瘤医院、中国科学院上海药物研究所、上海长海医院以及中国科学院分子细胞科学卓越创新中心。他们历经五年时间,完成了全球首个无功能性胰腺神经内分泌瘤(NF-pNET)多组学全景图谱的研究。
《癌细胞》(Cancer Cell)是国际顶级肿瘤学期刊,今日发表了该项重要研究成果,其影响因子为 48.8 分。
研究团队绘制出了全球首张无功能性胰腺神经内分泌瘤的图谱。这张图谱是多组学全景图谱。研究团队还根据此图谱提出了这种“沉默肿瘤”的分子分型框架。研究团队根据此图谱提出了这种“沉默肿瘤”的预后模型。研究团队根据此图谱提出了这种“沉默肿瘤”的靶向 - 免疫治疗新策略。这些成果为临床精准诊疗提供了重要依据。
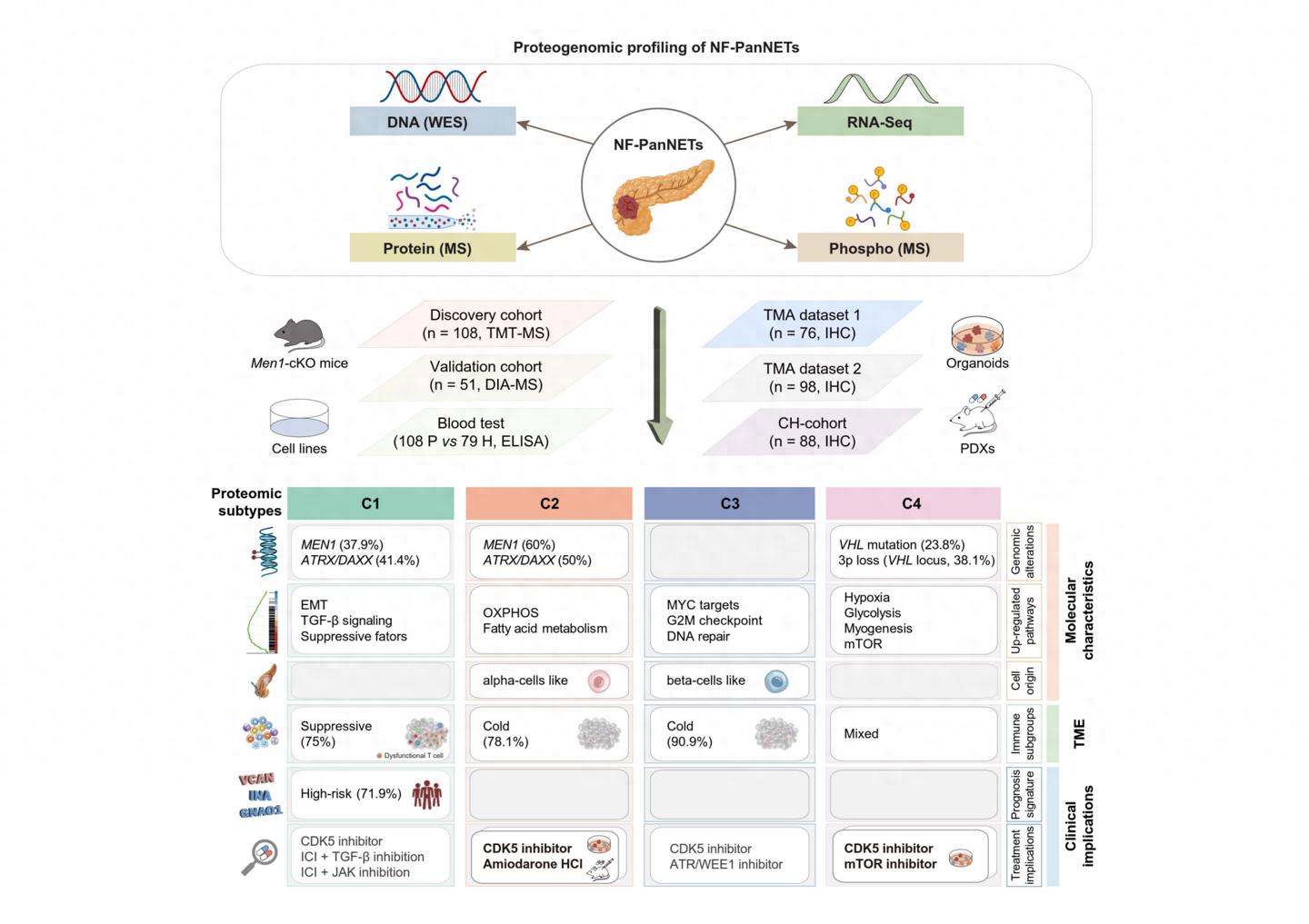
IT 之家指出:胰腺神经内分泌瘤在胰腺中较为常见,位居第二。其中约 90%的该肿瘤为无功能性。这类无功能性的胰腺神经内分泌瘤在早期是没有症状的,正因如此,它也被称作“沉默的肿瘤”。
虞先濬教授团队针对此类难题,联合了多中心研究团队。他们整合了基因组、转录组、蛋白质组和磷酸化修饰组这四种组学数据,对 108 例中国患者样本进行了多维分析。通过这些分析,他们绘制出了全景分子图谱,并且揭示了 MEN1、ATRX、DAXX 基因突变是如何通过干扰染色质结构稳定性和激活 mTOR 通路,从而驱动肿瘤恶性演进的机制。
研究团队借助 MEN1 基因条件性敲除小鼠模型进行了验证。验证的内容是 MEN1 缺失会引发代谢重编程以及增殖信号的交叉激活,形成恶性循环。这种恶性循环会致使染色体分离极为关键的 CENPV 蛋白下调。通过这样的研究,填补了该领域在机制研究方面的空白。另外,发现 CDK5、WASL 等基因的拷贝数出现扩增。这种扩增是无功能性胰腺神经内分泌瘤生长的驱动因素。并且,这些基因有望成为靶向治疗的潜在“靶标”。
研究团队为了解决这一临床困境,基于海量蛋白质组数据,利用前期研发的 ReProMSig 平台,通过人工智能算法筛选出 GNAO1、INA、VCAN 这三个蛋白质,构建了预后模型。该预后模型在对 345 例患者进行验证时显示出显著的区分度,其中高危组的五年生存率为 51.4%,低危组的五年生存率达 97.8%。更具突破性的一点在于,血浆 VCAN 浓度检测有希望能够替代组织活检,从而实现无创监测。
研究团队通过蛋白质组学特征聚类分析,进一步将无功能性胰腺神经内分泌瘤患者进行划分。他们把这些患者划分为了四种分子亚型,这种划分方式为临床治疗提供了精准的路线,就如同“按图索骥”一般。
其中 C1 亚型的肿瘤具有免疫抑制微环境且 EMT 通路被激活,这类患者的预后最差,亟需对免疫联合疗法进行探索;C2 亚型呈现出氧化磷酸化活性异常活跃的状态;C3 亚型是由 MYC 异常激活以及失控的细胞周期信号所主导的;C4 亚型在 VHL 突变的驱动下形成了独特的缺氧生态。
研究团队后续的药物研究证实了“四分型”的准确性。团队利用患者来源类器官(PDO)开展药物筛选,并且利用患者来源肿瘤异种移植模型(PDX)进行验证。基于各亚型特异激活的蛋白激酶和表达 / 活性上调蛋白,证实了 CDK5 抑制剂能够抑制四种分子亚型的肿瘤生长。钙离子通道阻滞剂(像心血管疾病经典药物盐酸胺碘酮)与 CDK5 抑制剂两药联用,在 C2 亚型中展现出了更好的抑瘤效果。目前临床运用的 mTOR 抑制剂能够较好地抑制 C4 亚型肿瘤。这些证据表明,依据“四分型”所形成的“分型而治”策略,给个体化精准治疗提供了科学方面的依据。
虞先濬教授称,此研究在国际上属首次,针对胰腺神经内分泌瘤临床队列进行了大规模的多组学综合分析。研究成果为无功能性胰腺神经内分泌瘤的发病机制解析、预后预测、分子分型及个体化治疗给予了坚实的理论依据,有望促使胰腺神经内分泌瘤研究领域快速发展。
本文采摘于网络,不代表本站立场,转载联系作者并注明出处:http://mjgaz.cn/fenxiang/275274.html

